Compilação com os melhores mapas mentais, conceituais, infográficos, diagramas e resumos sobre gases perfeitos.
Mapa Mental sobre gases perfeitos (1)
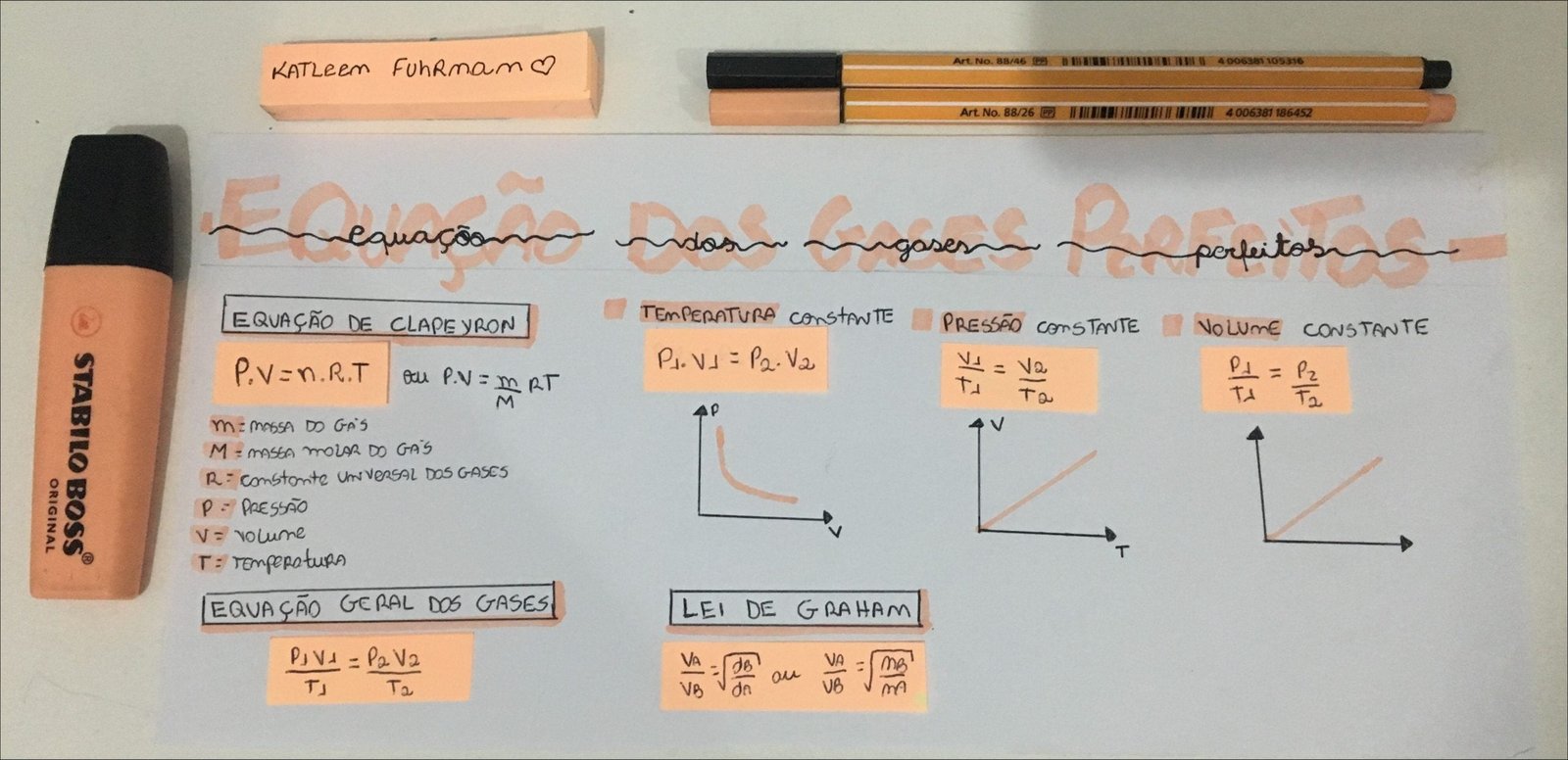
Mapa Mental sobre gases perfeitos (2)

Mapa Mental sobre gases perfeitos (3)
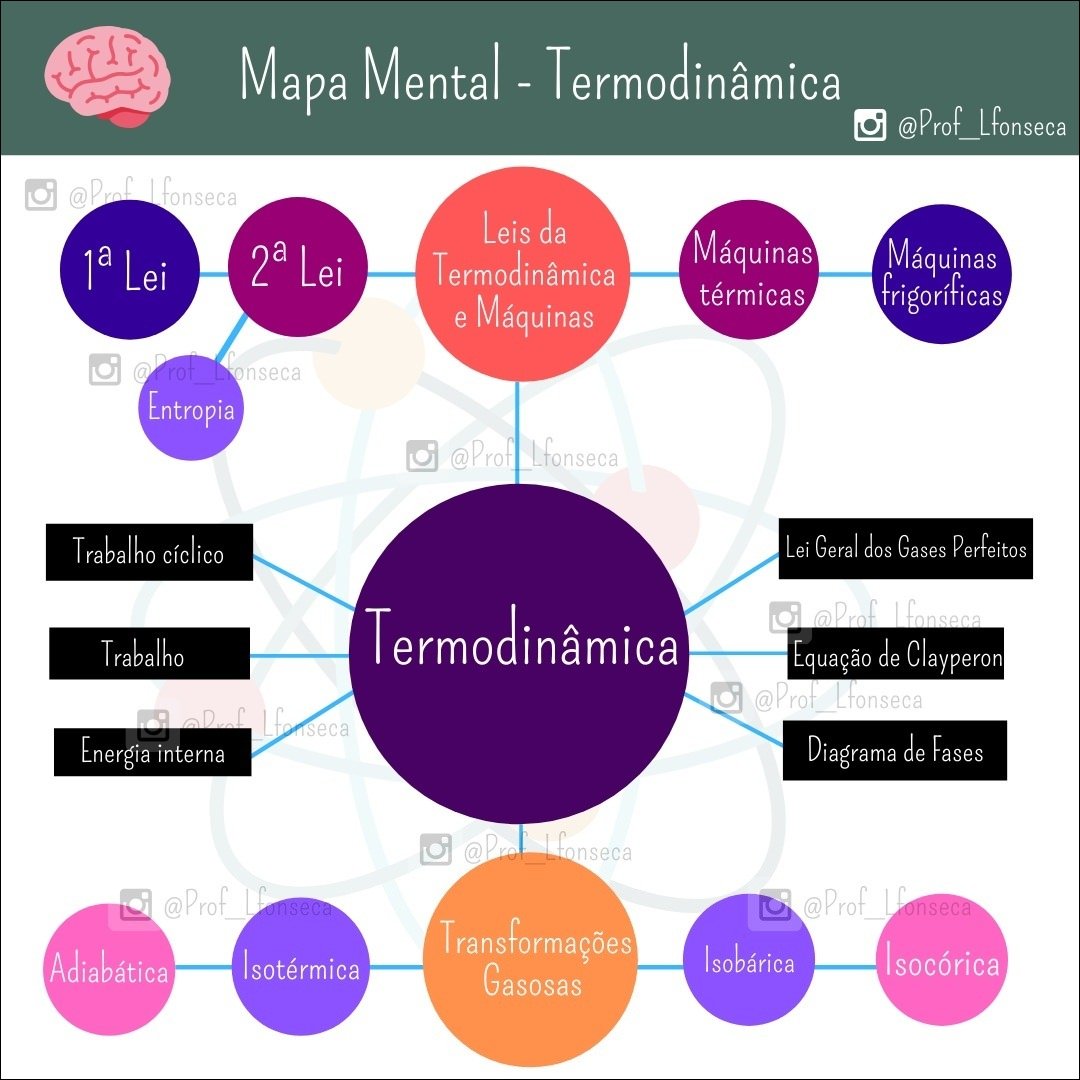
Mapa Mental sobre gases perfeitos (4)

Mapa Mental sobre gases perfeitos (5)
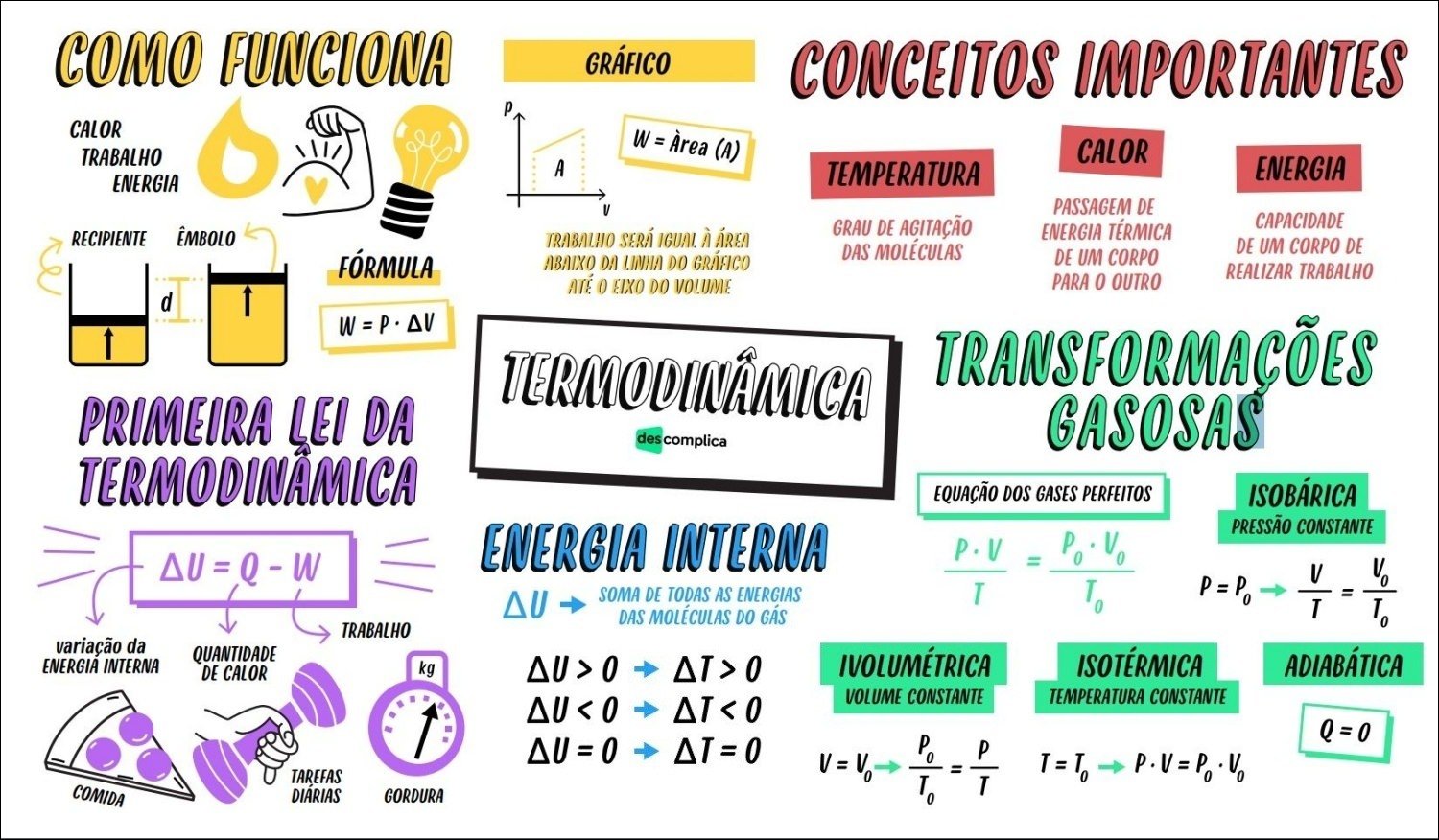
Mapa Mental sobre gases perfeitos (6)

Mapa Mental sobre gases perfeitos (7)

Mapa Mental sobre gases perfeitos (8)
Mapa Mental sobre gases perfeitos (9)

Resumo sobre gases perfeitos
Um gás perfeito (também conhecido como gás ideal) é um modelo teórico fundamental na termodinâmica e na física estatística. Ele descreve um gás que obedece rigorosamente a uma série de leis e simplificações, permitindo previsões precisas do comportamento de gases sob diversas condições.
As principais características de um gás perfeito incluem:
- Ausência de forças intermoleculares: As moléculas de um gás perfeito não exercem forças atrativas ou repulsivas entre si, exceto durante colisões.
- Volume molecular desprezível: O volume ocupado pelas moléculas individuais é insignificante em comparação com o volume total do gás.
- Colisões perfeitamente elásticas: As colisões entre as moléculas e com as paredes do recipiente são consideradas perfeitamente elásticas, ou seja, não há perda de energia cinética.
Essas simplificações levam à Equação de Estado do Gás Perfeito (PV = nRT), onde P é pressão, V é volume, n é o número de moles, R é a constante universal dos gases e T é a temperatura absoluta. Essa equação relaciona as propriedades termodinâmicas do gás, permitindo calcular pressão, volume ou temperatura se as outras variáveis forem conhecidas.
Embora nenhum gás real se comporte perfeitamente dessa maneira em todas as condições, o modelo do gás perfeito é uma excelente aproximação para gases diluídos (baixa densidade) e em altas temperaturas, onde as interações intermoleculares e o volume molecular são mínimos. Ele serve como uma base essencial para entender e modelar sistemas mais complexos, como gases reais e misturas gasosas, fornecendo um arcabouço para o estudo da termodinâmica e da física estatística.
