Compilação com os melhores mapas mentais, conceituais, infográficos, diagramas e resumos sobre ligações químicas.
Mapa Mental sobre ligações químicas (1)
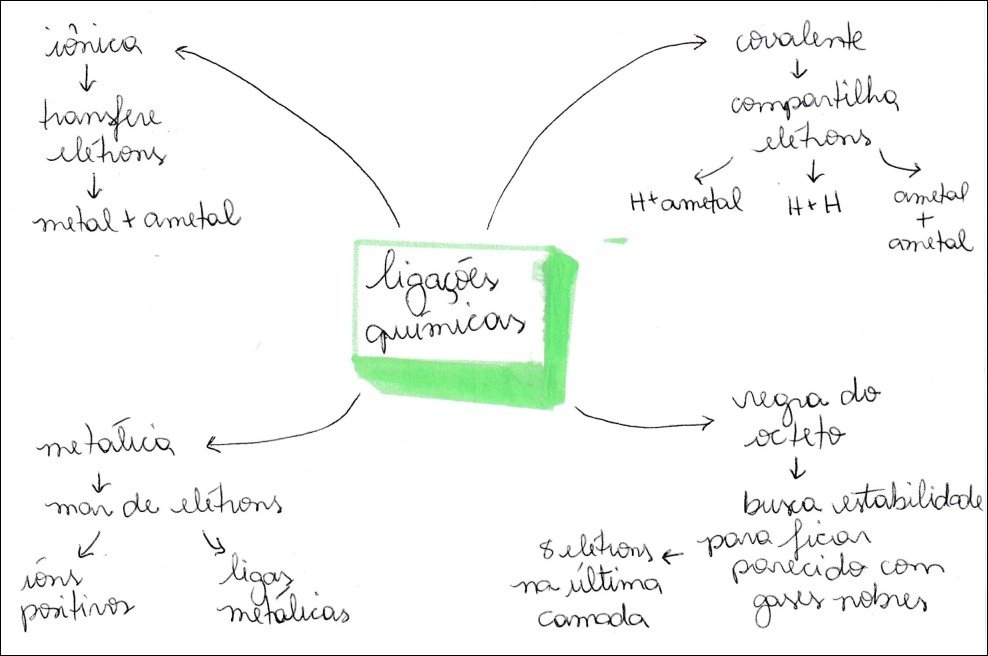
Mapa Mental sobre ligações químicas (2)

Mapa Mental sobre ligações químicas (3)
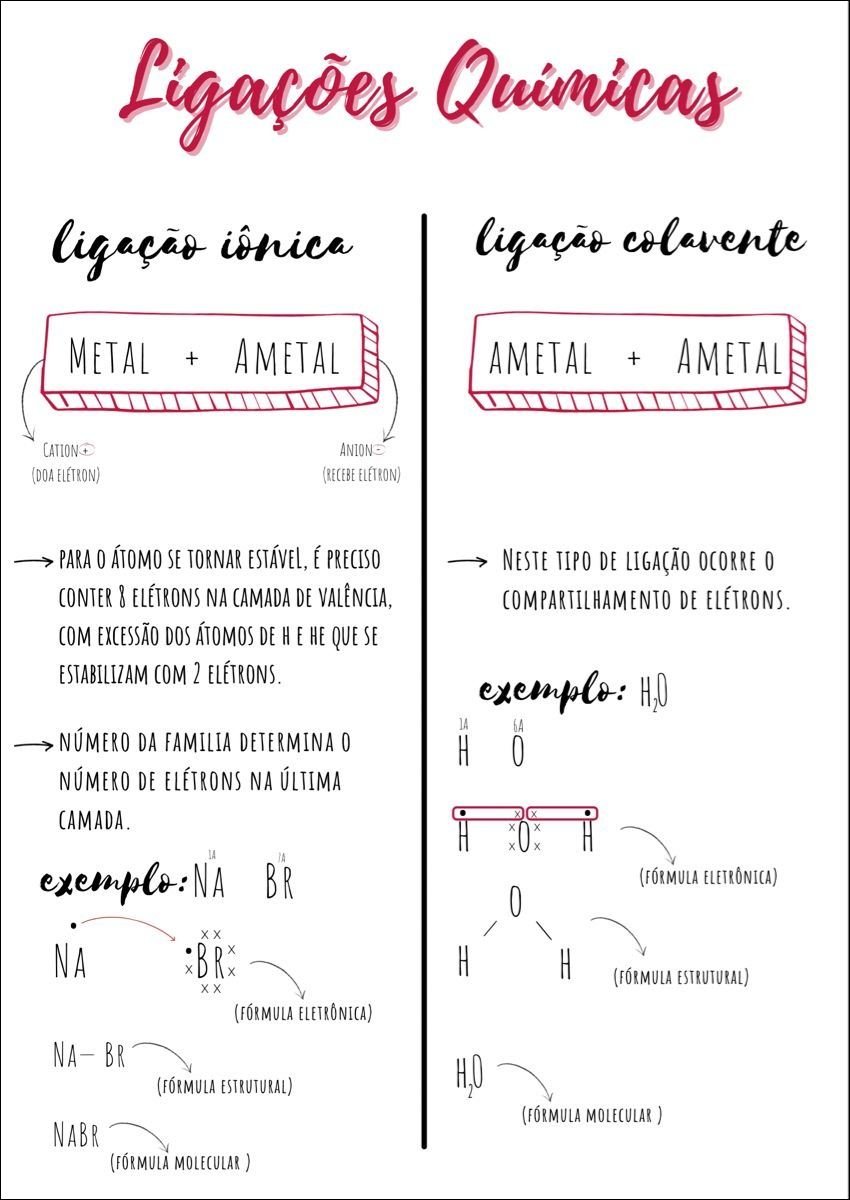
Mapa Mental sobre ligações químicas (4)

Mapa Mental sobre ligações químicas (5)

Mapa Mental sobre ligações químicas (6)

Mapa Mental sobre ligações químicas (7)

Mapa Mental sobre ligações químicas (8)
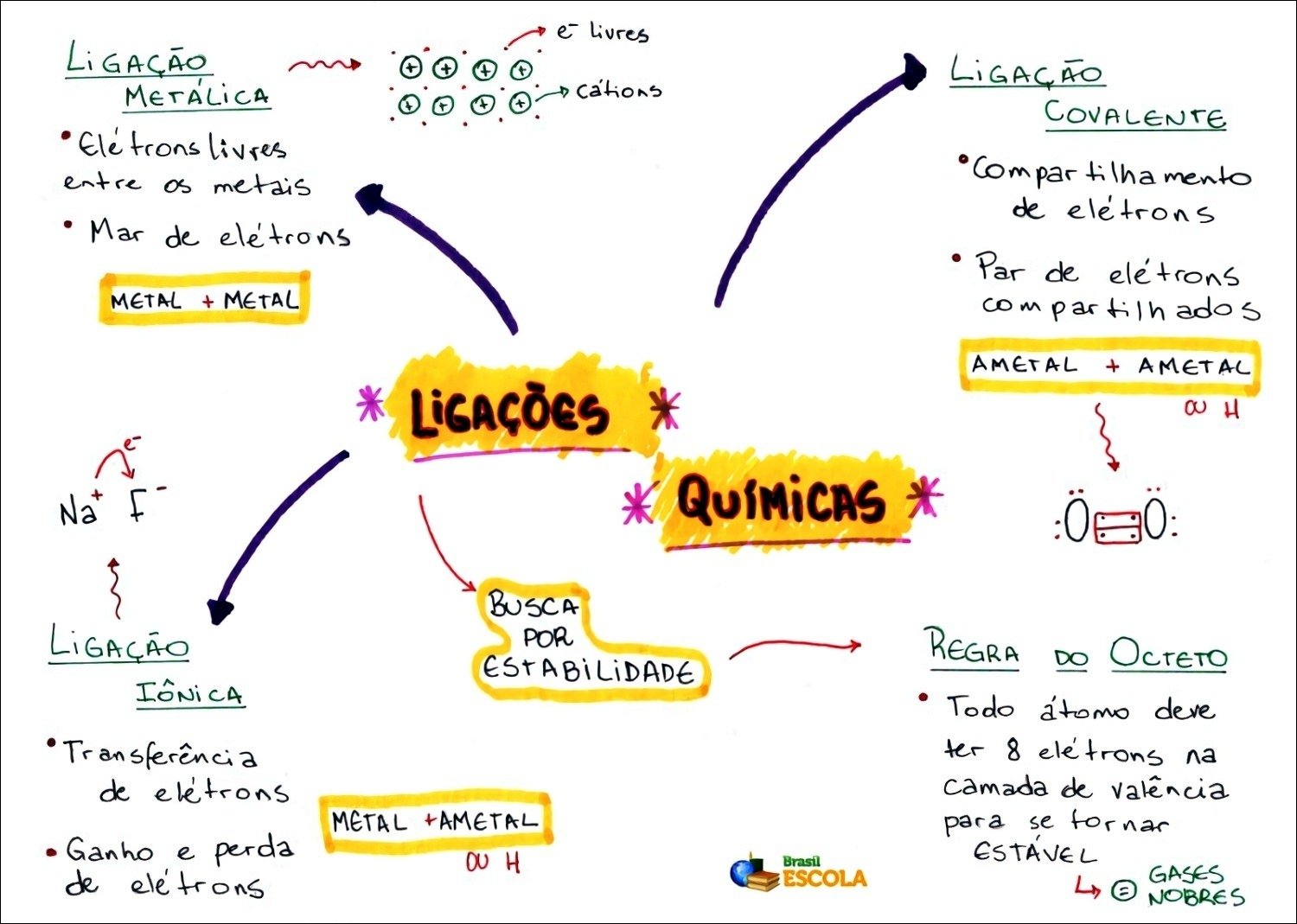
Mapa Mental sobre ligações químicas (9)

Mapa Mental sobre ligações químicas (10)

Mapa Mental sobre ligações químicas (11)

Mapa Mental sobre ligações químicas (12)
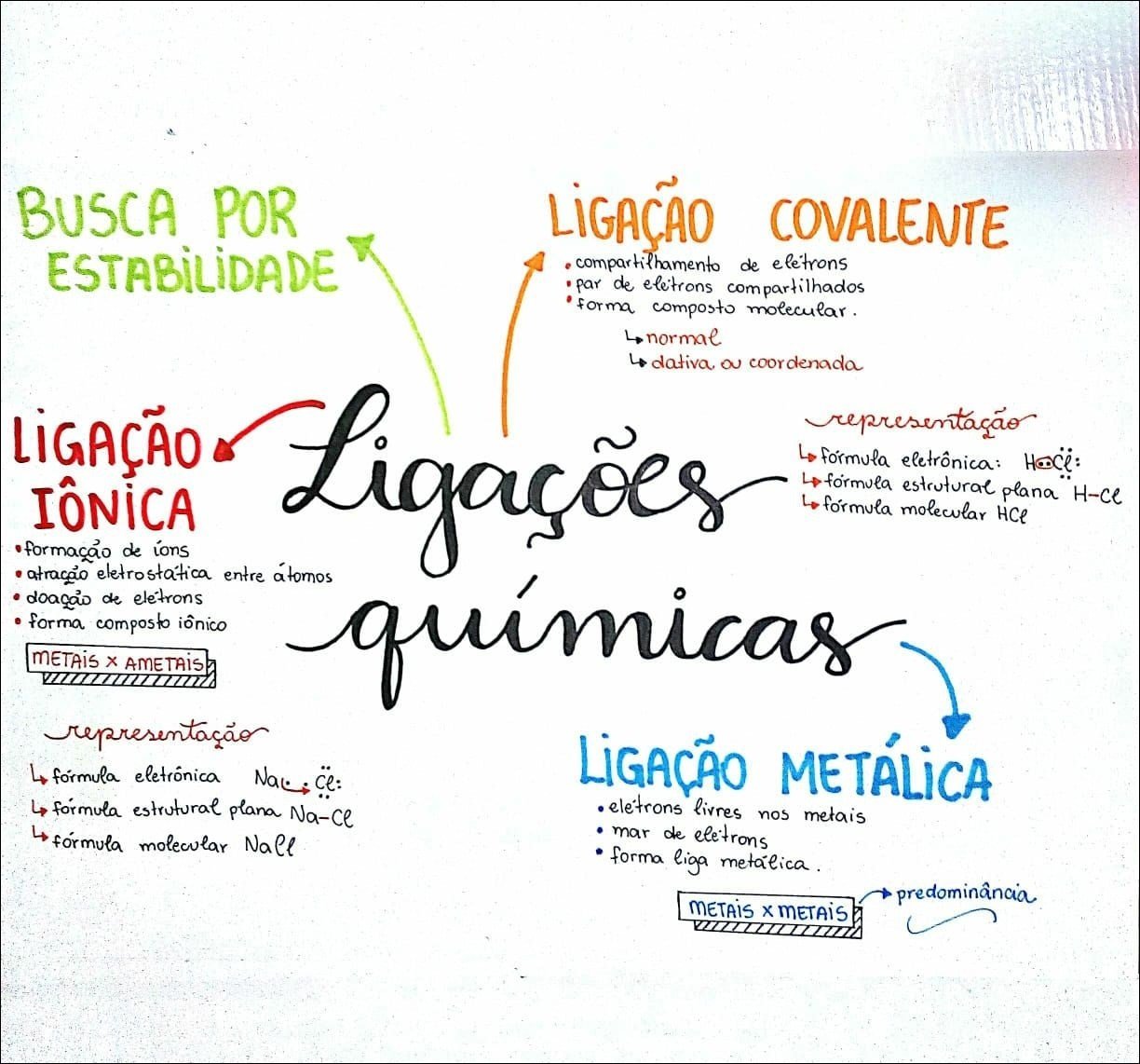
Mapa Mental sobre ligações químicas (13)

Mapa Mental sobre ligações químicas (14)

Mapa Mental sobre ligações químicas (15)

Mapa Mental sobre ligações químicas (16)
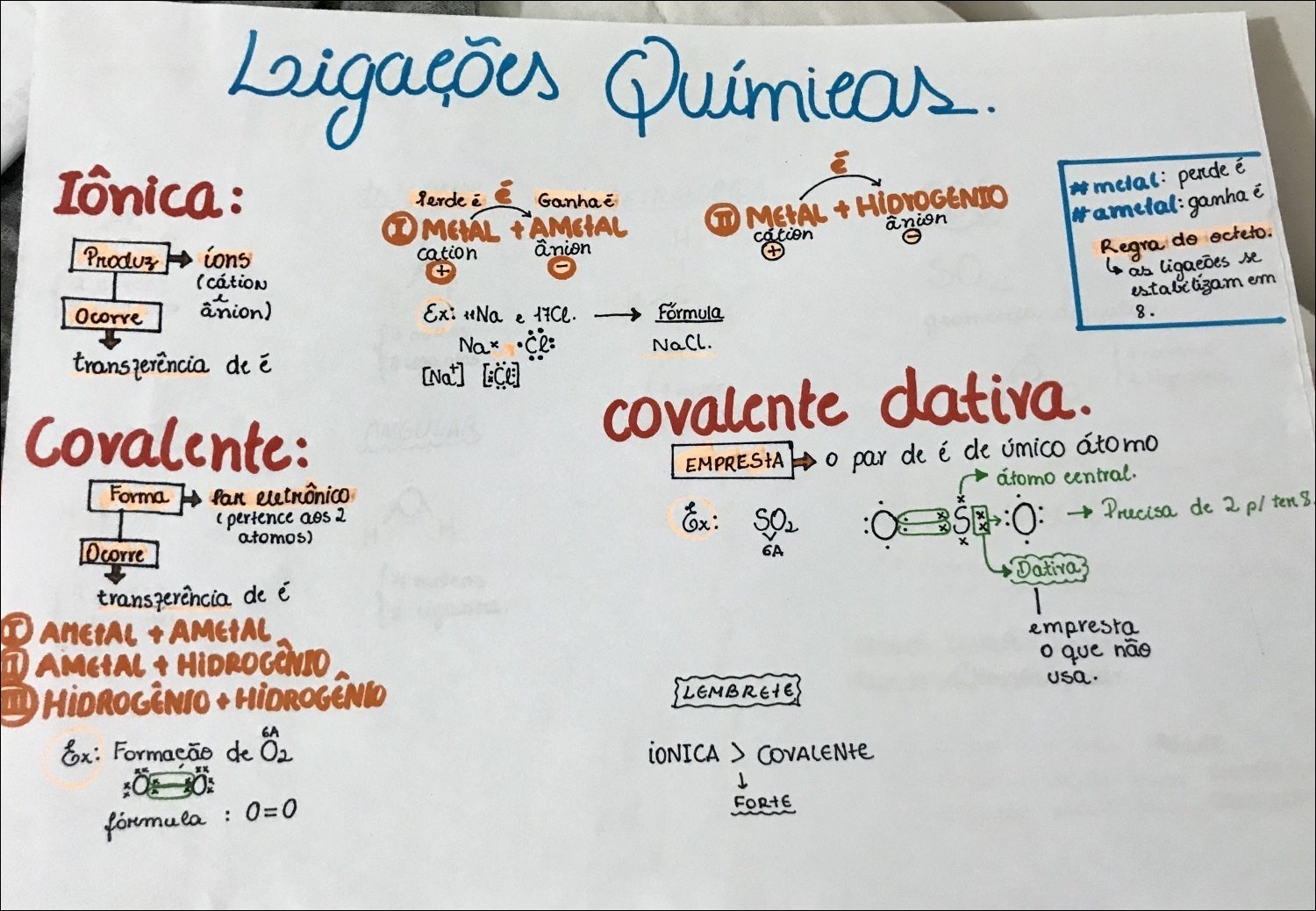
Mapa Mental sobre ligações químicas (17)
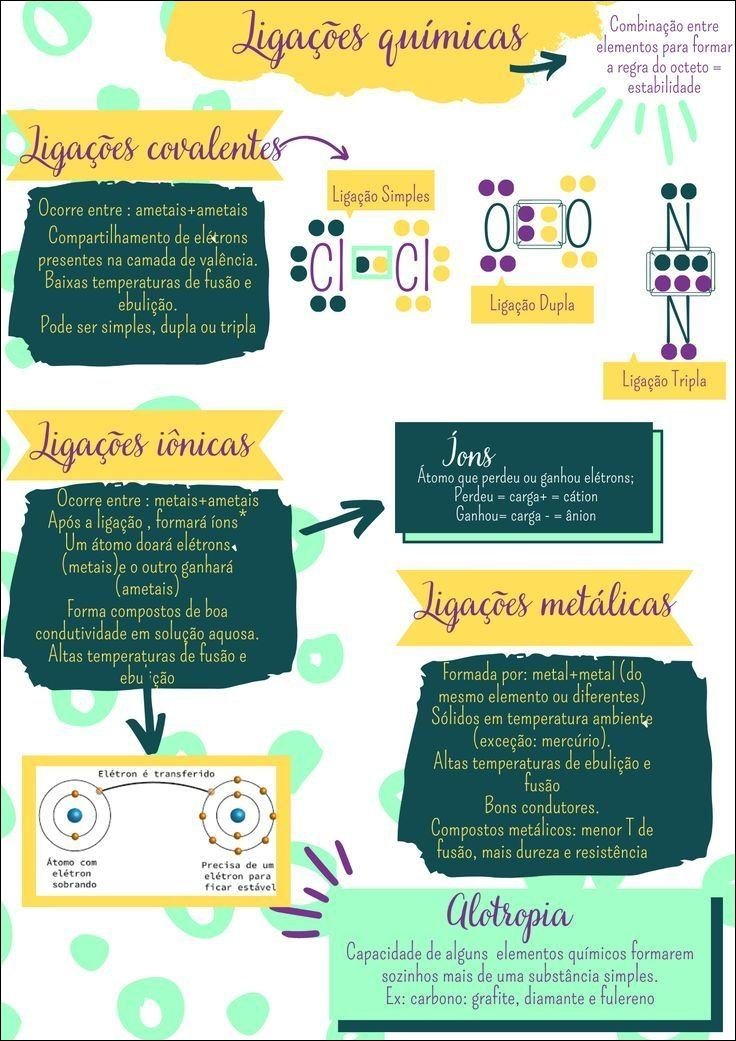
Mapa Mental sobre ligações químicas (18)
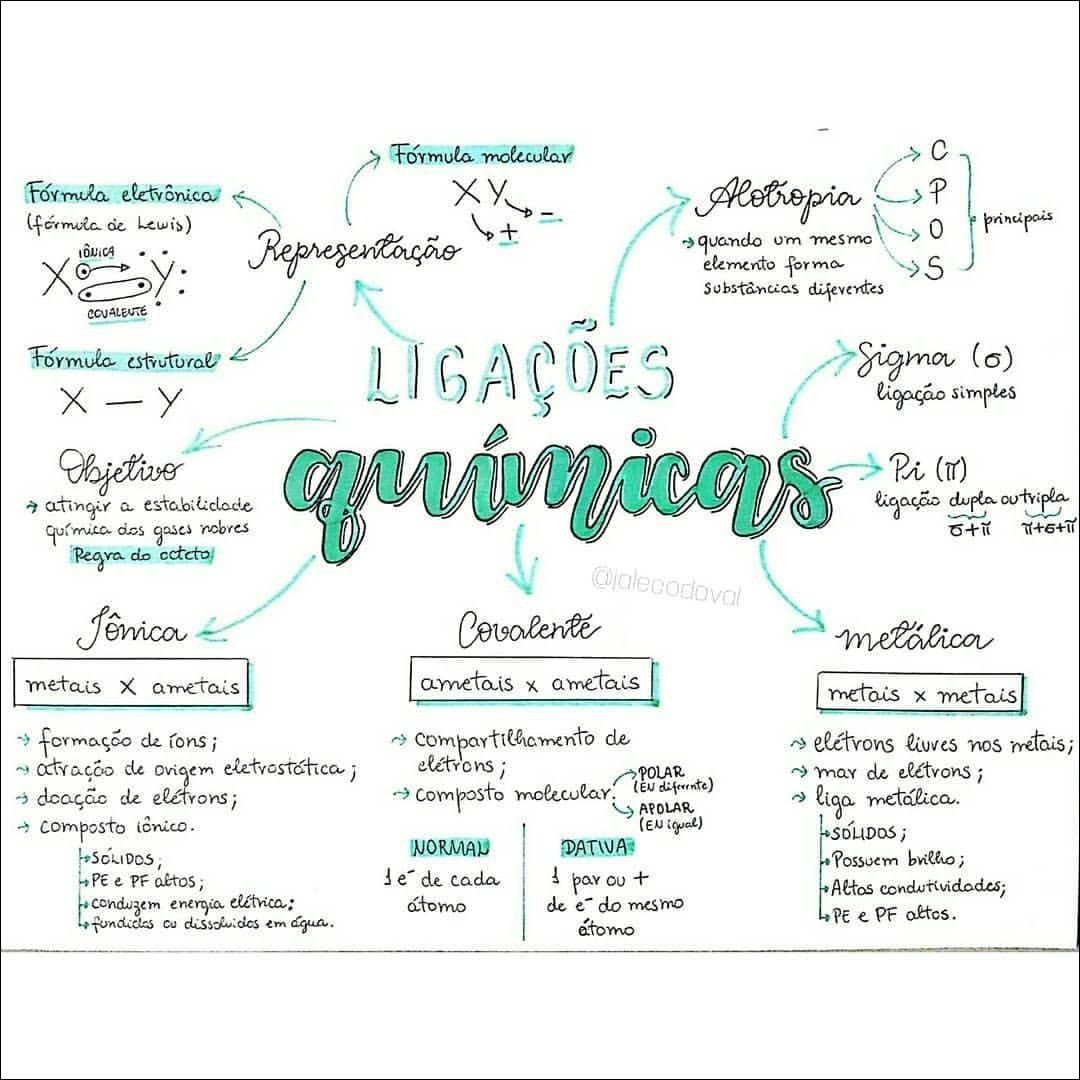
Mapa Mental sobre ligações químicas (19)

Mapa Mental sobre ligações químicas (20)

Resumo sobre ligações químicas
Ligações Químicas: A Arquitetura da Matéria
As ligações químicas são as forças que unem átomos, permitindo a formação de moléculas e a construção de toda a matéria que nos cerca. Elas surgem da busca dos átomos por uma configuração eletrônica mais estável, geralmente semelhante à dos gases nobres, com sua camada de valência completa. Existem três tipos principais de ligações químicas: iônica, covalente e metálica.
A ligação iônica ocorre através da transferência de elétrons entre átomos com grande diferença de eletronegatividade. Um átomo “doa” elétrons, tornando-se um íon positivo (cátion), enquanto outro “recebe” elétrons, tornando-se um íon negativo (ânion). A atração eletrostática entre os íons de cargas opostas mantém a ligação, formando compostos como o sal de cozinha (NaCl).
Na ligação covalente, átomos compartilham elétrons para completar suas camadas de valência. Essa partilha pode ser igual (covalente apolar, como na molécula de hidrogênio, H₂) ou desigual (covalente polar, como na água, H₂O), dependendo da eletronegatividade dos átomos. A ligação covalente é fundamental para a formação de moléculas orgânicas complexas, como proteínas e DNA.
A ligação metálica envolve a união de átomos metálicos. Os elétrons de valência se deslocalizam, formando uma “nuvem de elétrons” que envolve os íons metálicos positivos. Essa nuvem eletrônica confere aos metais suas propriedades características, como condutividade elétrica e térmica, brilho e maleabilidade.
A compreensão das ligações químicas é essencial para entender as propriedades das substâncias, suas reações e, consequentemente, o mundo ao nosso redor. Ela é fundamental em áreas como química, biologia, ciência dos materiais e muito mais.
